O que é balanceamento de equações químicas?
Uma equação química é uma descrição escrita do que acontece em uma reação química. Os materiais de partida, chamados reagentes, estão listados no lado esquerdo da equação. Em seguida vem uma seta que indica a direção da reação. O lado direito da reação lista as substâncias que são feitas, chamadas produtos.
O que é o balanceamento de equações químicas?
Uma equação química equilibrada informa as quantidades de reagentes e produtos necessários para satisfazer a Lei de Conservação de Massa. Basicamente, isso significa que há os mesmos números de cada tipo de átomo no lado esquerdo da equação do que no lado direito. da equação. Parece que deve ser simples equilibrar as equações, mas é uma habilidade que requer prática. Aqui está o processo que você segue, passo a passo, para equilibrar as equações. Você pode aplicar essas mesmas etapas para equilibrar qualquer equação química que não estiver balanceada.
Leia também
Balanceamento químico: como fazer?
Você deve começar seguindo os passos abaixo para balancear uma equação.
Passo 1: Escreva a Equação Química Desbalanceada
O primeiro passo é escrever a equação química ainda não balanceada. Se você tiver sorte, ela será dada a você. Se você for instruído a balancear uma equação química e apenas os nomes dos produtos e reagentes, será necessário procurá-los ou aplicar regras de nomeação de compostos para determinar suas fórmulas. Vamos praticar usando uma reação da vida real, a ferrugem do ferro no ar. Para escrever a reação, você precisa identificar os reagentes (ferro e oxigênio) e os produtos (ferrugem). Em seguida, escreva a equação química desequilibrada:
Fe + O2 → Fe2O3
Observe que os reagentes sempre vão do lado esquerdo da seta. Um sinal de “mais” separa-os. Em seguida, há uma seta indicando a direção da reação (reagentes tornam-se produtos). Os produtos estão sempre no lado direito da seta. A ordem em que você escreve os reagentes e produtos não é importante.
Passo 2: Anote o número de átomos
O próximo passo para equilibrar a equação química é determinar quantos átomos de cada elemento estão presentes em cada lado da seta:
Fe + O2 → Fe2O3
Para fazer isso, tenha em mente que um índice indica o número de átomos. Por exemplo, o O2 tem 2 átomos de oxigênio. Existem 2 átomos de ferro e 3 átomos de oxigênio em Fe2O3. Existe 1 átomo em Fe. Quando não há subscrito, significa que há 1 átomo.
No lado dos reagentes:
1 Fe
2 O
No lado do produto:
2 Fe
3 O
Como você sabe que a equação não está equilibrada? Porque o número de átomos em cada lado não é o mesmo! A conservação da massa dos estados de massa não é criada ou destruída em uma reação química; portanto, é necessário adicionar coeficientes na frente das fórmulas químicas para ajustar o número de átomos, de modo que eles sejam os mesmos em ambos os lados.
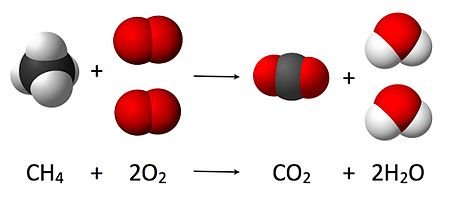
O balanceamento de equações é parte integral da química, essencial para completar as reações químicas. (Foto: Wikipedia)
Passo 3: Adicionar coeficientes para equilibrar a massa em uma equação química
Ao balancear equações, você nunca altera os subscritos. Você adiciona coeficientes. Os coeficientes são multiplicadores de números inteiros. Se, por exemplo, você escreve 2H2O, isso significa que você tem 2 vezes o número de átomos em cada molécula de água, o que seria 4 átomos de hidrogênio e 2 átomos de oxigênio. Tal como acontece com os subscritos, você não escreve o coeficiente de “1”, então se você não vê um coeficiente, isso significa que há uma molécula. Existe uma estratégia que o ajudará a equilibrar as equações mais rapidamente. É chamado de balanceamento por inspeção. Basicamente, você observa quantos átomos tem em cada lado da equação e adiciona coeficientes às moléculas para equilibrar o número de átomos.
Equilibre os átomos presentes em uma única molécula de reagente e produto primeiro.
Equilibre os átomos de oxigênio ou hidrogênio por último.
No exemplo:
Fe + O2 → Fe2O3
O ferro está presente em um reagente e em um produto, portanto, primeiro equilibre seus átomos. Há um átomo de ferro à esquerda e dois à direita, então você pode pensar que colocar 2 Fe à esquerda funcionaria. Enquanto isso equilibra o ferro, você já sabe que terá que ajustar o oxigênio também, porque não está equilibrado. Por inspeção (ou seja, olhando para ele), você sabe que tem que descartar um coeficiente de 2 para um número maior.
3 Fe não funciona à esquerda porque você não pode colocar um coeficiente de Fe2O3 que o equilibre.
4 Fe funciona, se você adicionar um coeficiente de 2 na frente da ferrugem (óxido de ferro), tornando-se 2 Fe2O3. Isso te dá:
4 Fe + O2 → 2 Fe2O3
O ferro é balanceado, com 4 átomos de ferro em cada lado da equação. Em seguida, você precisa equilibrar o oxigênio.
Esta é a equação balanceada para o ferro:
4 Fe + O2 → 2 Fe2O3
Ao equilibrar as equações químicas, o último passo é adicionar coeficientes aos átomos de oxigênio e hidrogênio. A razão é porque eles geralmente aparecem em vários reagentes e produtos, por isso, se você os abordar primeiro, normalmente você está fazendo um trabalho extra para si mesmo.
Agora, observe a equação (use inspeção) para ver qual coeficiente funcionará para equilibrar o oxigênio. Se você colocar um 2 em de O2, isso lhe dará 4 átomos de oxigênio, mas você tem 6 átomos de oxigênio no produto (coeficiente de 2 multiplicado o subscrito de 3). Então, 2 não funciona.
Se você tentar 3 O2, então você tem 6 átomos de oxigênio no lado reagente e também 6 átomos de oxigênio no lado do produto. Isso funciona. A equação química balanceada é:
4 Fe + 3 O2 → 2 Fe2O3
Balanceamento de equação química: forma mais simples é a correta!
Você poderia ter escrito uma equação balanceada usando múltiplos dos coeficientes. Por exemplo, se você duplicar todos os coeficientes, ainda terá uma equação balanceada:
8 Fe + 6 O2 → 4 Fe2O3
No entanto, os químicos escrevem sempre a equação mais simples, portanto, verifique seu trabalho para certificar-se de que você não pode reduzir seus coeficientes.
É assim que você equilibra uma equação química simples para massa. Você também pode precisar equilibrar equações para massa e carga. Além disso, você pode precisar indicar o estado (sólido, aquoso, gás) dos reagentes e produtos.
Ficou alguma dúvida? Deixem nos comentários suas perguntas e iremos ajudar!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também

O que é o gás oxigênio? Como é produzido?

O que é e para que serve a energia cinética?

Corrosão, o que é? Exemplos e tipos!
O que é equação química?