Ligação covalente: conceito e exemplos!
Ligações covalentes são um dos tios de ligações químicas possíveis entre dois ou mais elementos, Compreender esse tipo de ligação é essencial para os estudantes de química e para aqueles que querem entender melhor como funcionam as reações químicas. Vamos tentar explicar em detalhes o que são as ligações covalentes, dando também exemplos.
O que são ligações covalentes?
Uma ligação covalente na química é uma ligação química entre dois átomos ou íons em que os pares de elétrons são compartilhados entre eles. Uma ligação covalente pode também ser denominada uma ligação molecular. As ligações covalentes formam-se entre dois átomos não-metálicos com valores de eletronegatividade idênticos ou relativamente próximos. Este tipo de ligação também pode ser encontrado em outras espécies químicas, como radicais e macromoléculas.
Leia também
Os pares de elétrons que participam de uma ligação covalente são chamados de pares de ligação ou pares compartilhados. Tipicamente, o compartilhamento de pares de ligação permite que cada átomo atinja um escudo de elétrons externo estável, semelhante ao observado em átomos de gás nobre.
Ligações covalentes polares e ligações covalentes apolares
Dois tipos importantes de ligações covalentes são ligações covalentes não polares ou puras e ligações covalentes polares. Ligações não-polares ocorrem quando os átomos compartilham igualmente pares de elétrons. Uma vez que apenas átomos idênticos (com a mesma eletronegatividade) realmente se envolvem em compartilhamento igual, a definição é expandida para incluir ligação covalente entre quaisquer átomos com uma diferença de eletronegatividade menor que 0,4. Exemplos de moléculas com ligações não polares são H2, N2 e CH4.
À medida que a diferença de eletronegatividade aumenta, o par de elétrons em uma ligação está mais intimamente associado a um núcleo do que ao outro. Se a diferença de eletronegatividade estiver entre 0,4 e 1,7, a ligação é polar. Se a diferença de eletronegatividade for maior que 1,7, a ligação é iônica.
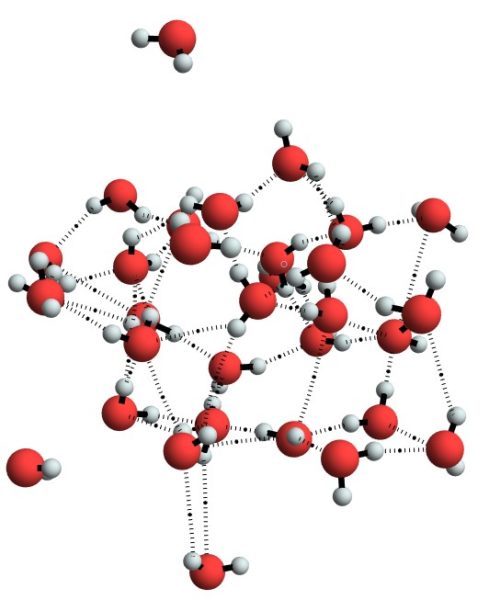
A ligação covalente pode ser polar ou apolar, e é uma das formas dos elementos se ligarem entre si. (Foto: Chemistry Stack Exchange)
Exemplos de ligações covalentes
Existe uma ligação covalente entre o oxigênio e cada hidrogênio em uma molécula de água (H2O). Cada uma das ligações covalentes contém dois elétrons, um de um átomo de hidrogênio e outro do átomo de oxigênio. Ambos os átomos compartilham os elétrons.
Uma molécula de hidrogênio, H2, consiste em dois átomos de hidrogênio unidos por uma ligação covalente. Cada átomo de hidrogênio precisa de dois elétrons para alcançar um escudo de elétrons externo estável. O par de elétrons é atraído pela carga positiva de ambos os núcleos atômicos, mantendo a molécula unida.
O fósforo pode formar PCl3 ou PCl5. Em ambos os casos, os átomos de fósforo e cloro estão ligados por ligações covalentes. PCl3 assume a estrutura esperada de gás nobre, na qual os átomos atingem as camadas externas de elétrons. No entanto, PCl5 também é estável, por isso é importante lembrar que as ligações covalentes na química nem sempre obedecem à regra do octeto.
Compostos covalentes também são conhecidos como compostos moleculares. Compostos orgânicos, como carboidratos, lipídios, proteínas e ácidos nucléicos, são exemplos de compostos moleculares. Você pode reconhecer esses compostos porque eles consistem de não-metais colados uns aos outros.
PCl3 – tricloreto de fósforo
CH3CH2OH – etanol
O3 – ozônio
H2 – hidrogênio
H2O – água
HCl – cloreto de hidrogênio
CH4 – metano
NH3 – amônia
CO2 – dióxido de carbono
Assim, por exemplo, você não esperaria encontrar ligações covalentes em um metal ou liga, como prata, aço ou latão. Você encontraria ligações iônicas em vez de covalentes em um sal, como o cloreto de sódio.
O que determina se uma ligação covalente se forma?
As ligações covalentes formam-se quando dois átomos não metálicos têm valores de eletronegatividade iguais ou semelhantes. Então, se dois não-metais idênticos (por exemplo, dois átomos de hidrogênio) se ligam, eles formarão uma ligação covalente pura. Quando dois não-metais dissimilares formam ligações (por exemplo, hidrogênio e oxigênio), eles formarão uma ligação covalente, mas os elétrons passarão mais tempo perto de um tipo de átomo do que o outro, produzindo uma ligação polar covalente.
Ficou alguma dúvida sobre as ligações covalentes? Deixem nos comentários suas perguntas!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também
O que é número atômico?

O que é o gás oxigênio? Como é produzido?
O que é equação química?

O que são funções inorgânicas?