O que são funções inorgânicas?
Com esta lição, você aprenderá a definição de química inorgânica. Você também aprenderá os tipos de compostos inorgânicos, como eles reagem e suas aplicações, além das definições para as funções inorgânicas e as características de cada uma delas.
O que é a química inorgânica?
Nós ouvimos sobre orgânico principalmente em termos de comida, onde significa que o que você está prestes a comer foi cultivado sem o uso de pesticidas. Mas na química, a palavra orgânico significa que você está lidando com compostos de carbono. O carbono é um elemento com o qual você pode estar familiarizado. É um elemento presente em todas as formas de vida e é o quarto elemento mais abundante do universo. A química orgânica é basicamente o estudo das ligações carbono-hidrogênio. A química inorgânica, por outro lado, é o oposto. É o estudo da formação, síntese e propriedades de compostos que não contêm ligações carbono-hidrogênio. Existem cerca de 100.000 compostos inorgânicos conhecidos, enquanto existem cerca de dois milhões de compostos orgânicos conhecidos. Exemplos de compostos inorgânicos incluem:
Leia também
Cloreto de sódio (NaCl): usado como sal de mesa
Dióxido de silício (SiO2): usado em chips de computador e células solares
Safira (Al2O3): uma pedra preciosa bem conhecida
Ácido sulfúrico (H2SO4): um produto químico amplamente utilizado na produção de fertilizantes e alguns produtos domésticos, tais como limpadores de esgotos
O que são funções inorgânicas?
Funções inorgânicas são grupos de compostos inorgânicos. As principais funções da química inorgânica são os ácidos, as bases, os sais e os óxidos.
Ácidos
Ácidos são compostos que produzem íons H + quando dissolvidos em água. Exemplos de ácidos incluem ácido sulfúrico (HSO4), ácido clorídrico (HCl), ácido fluorídrico (HF), ácido ascético ou vinagre (HC2H3O2) e ácido cítrico (C6H8O7). A maioria dos ácidos pode ser dissolvida em água e é corrosiva, e aqueles que podem ser ingeridos têm um sabor amargo. Na água, o HCl é decomposto em H + e Cl-
HCl —- (H +) + (Cl-)
Bases
Bases são compostos que produzem OH- (íons hidroxila) quando dissolvidas em água. Elas são geralmente encontrados em produtos domésticos. Algumas bases comuns são amônia (NH3), hidróxido de potássio (KOH), hidróxido de cálcio ou cal cáustico (Ca2OH) e hidróxido de sódio ou soda cáustica (NaOH). Na água, o KOH se dissocia em K + e OH-:
KOH —- (K +) + (OH-)

Compreender a química inorgânica é essencial para a compreensão das bases da química. (Foto: forooghedanesh.com)
Sais
Sais são compostos que resultam da reação entre um ácido e uma base. São compostos iônicos formados por dois íons de carga oposta (átomos que não são eletricamente neutros porque perderam ou ganharam um ou mais elétrons). Por exemplo, sal de mesa ou cloreto de sódio (NaCl) é formado pela ligação de um ânion (íon carregado positivamente) e um cátion (íon carregado negativamente): Na + e Cl-. Alguns sais comuns incluem cloreto de sódio ou sal de mesa (NaCl), cloreto de cálcio (CaCl2), cloreto de magnésio (MgCl2) e cloreto de potássio (KCl). A maioria dos sais pode ser dissolvida em água para formar uma solução dos íons. Íons derivados de sais como Na +, Mg + 2 e K + são críticos para o funcionamento do corpo humano. Na água, o CaCl2 é decomposto da seguinte maneira:
CaCl2 —– (Ca + 2) + (Cl-)
Óxidos
Óxidos são compostos que contem pelo menos um átomo de oxigênio combinado com outro elemento. O oxigênio geralmente está na forma de um ânion (O2-). Os óxidos de metais de transição, como o óxido de titânio (III) (Ti2O3) e o óxido de ferro (III) (Fe2O3), possuem propriedades magnéticas e catalíticas úteis. Vamos dar alguns exemplos de reações.
Química inorgânica descritiva
Isto diz respeito à classificação de compostos com base nas suas propriedades. Utiliza a posição na tabela periódica do elemento mais pesado no composto (isto é, aquele com o maior peso atômico), e também envolve o agrupamento de compostos de acordo com as suas semelhanças estruturais. Exemplos de classificações dentro da química inorgânica descritiva incluem compostos de coordenação, compostos de “grupo principal”, compostos de metal de transição, compostos de aglomerados, compostos bioinorgânicos e compostos de estado sólido.
Esta área da química inorgânica pode ser pensada como uma extensão do conhecimento dos elementos mencionados nas seções acima na descrição sistemática de compostos inorgânicos.
Tipos básicos de reações químicas inorgânicas
Reações de Combinação, onde duas ou mais substâncias se combinam para formar uma única substância química
Reações de decomposição, que é o oposto das “reações de combinação”, ou seja, uma substância se decompõe em suas partes químicas
Reações de deslocamento único (simples troca), quando um átomo ou íon que faz parte de um único composto é substituído por um átomo ou íon de um elemento diferente.
Reações de deslocamento duplo (dupla troca), quando elementos de dois compostos diferentes se deslocam para formar compostos não presentes no início da reação e que são devidos a diferentes combinações dos elementos presentes nos compostos originais.
Para começar a estudar a química inorgânica, esses termos são suficientes, mas é bom ter um planejamento e pensar nos exercícios e temas para ter um estudo mais eficiente do assunto.
Ficou alguma dúvida? Quer ver mais material de química no nosso blog? Deixem nos comentários suas sugestões e perguntas que iremos ajudar!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também
O que é número atômico?

Corrosão, o que é? Exemplos e tipos!
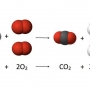
O que é equação química?

Qual a classificação das proteínas?