Reações endotérmicas e exotérmicas
Reações endotérmicas e exotérmicas devem ser conhecidas por aqueles que estão estudando os processos químicos. Não é difícil, assim que você entender o básico das diferenças entre elas. Vamos explicar em detalhes as diferenças entre cada uma delas para que fique fácil a compreensão e seu conhecimento de química melhore.
O que é uma reação exotérmica?
Muitas reações químicas liberam energia na forma de calor, luz ou som. Estas são reações exotérmicas. Reações exotérmicas podem ocorrer espontaneamente e resultar em maior aleatoriedade ou entropia (ΔS> 0) do sistema. Eles são denotados por um fluxo de calor negativo (o calor é perdido para o ambiente) e diminui a entalpia (ΔH <0). No laboratório, as reações exotérmicas produzem calor ou podem até ser explosivas.
Leia também
O que é uma reação endotérmica?
Existem outras reações químicas que devem absorver energia para prosseguir. Estas são reações endotérmicas. Reações endotérmicas não podem ocorrer espontaneamente. O trabalho deve ser feito para que essas reações ocorram. Quando as reações endotérmicas absorvem energia, uma queda de temperatura é medida durante a reação. As reações endotérmicas são caracterizadas pelo fluxo de calor positivo (na reação) e um aumento na entalpia (+ ΔH).
Exemplos de processos endotérmicos e exotérmicos
A fotossíntese é um exemplo de reação química endotérmica. Neste processo, as plantas usam a energia do sol para converter dióxido de carbono e água em glicose e oxigênio. Esta reação requer 15MJ de energia (luz solar) para cada quilograma de glicose produzido:
Luz solar + 6CO2 (g) + H2O (l) = C6H12O6 (aq) + 6O2 (g)
Outros exemplos de processos endotérmicos incluem:
- Dissolução de cloreto de amônio em água
- Alcanos de craqueamento
- Nucleossíntese de elementos mais pesados que o níquel em estrelas
- Água líquida de evaporação
- Derreter gelo
Um exemplo de uma reação exotérmica é a mistura de sódio e cloro para produzir sal de mesa. Esta reação produz 411 kJ de energia para cada mole de sal produzido:
Na (s) + 0,5Cl2 (s) = NaCl (s)
Outros exemplos de processos exotérmicos incluem:
- A reação termita
- Uma reação de neutralização (por exemplo, mistura de um ácido e uma base para formar um sal e água)
- A maioria das reações de polimerização
- Combustão de um combustível
- Ficão nuclear
- Corrosão de metal (uma reação de oxidação)
- Dissolvendo um ácido na água
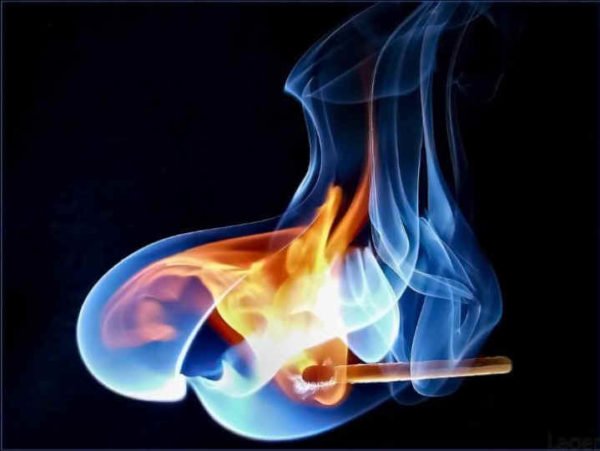
Reações endotérmicas e exotérmicas tem diferenças fáceis de identificar para a compreensão da química. (Foto: Kent Chemistry)
Comparação da reação endotérmica e exotérmica
Aqui está um breve resumo das diferenças entre reações endotérmicas e exotérmicas:
Na reação exotérmica:
- O calor é absorvido (fica frio)
- Energia deve ser adicionada para que a reação ocorra
- Entropia diminui (ΔS <0)
- Aumento na entalpia (+ ΔH)
Na reação endotérmica:
- O calor é liberado (fica quente)
- A reação ocorre espontaneamente
- A entropia aumenta (ΔS> 0)
- Diminuição na entalpia (-ΔH)
Reações endergônicas e exergônicas
Reações endotérmicas e exotérmicas referem-se à absorção ou liberação de calor. Existem outros tipos de energia que podem ser produzidos ou absorvidos por uma reação química. Exemplos incluem luz e som. Em geral, reações envolvendo energia podem ser classificadas como endergônicas ou exergônicas. Uma reação endotérmica é um exemplo de reação endergônica. Uma reação exotérmica é um exemplo de reação exergônica.
Reações endotérmicas e exotérmicas são reações químicas que absorvem e liberam calor, respectivamente. Um bom exemplo de reação endotérmica é a fotossíntese. A combustão é um exemplo de uma reação exotérmica.
A categorização de uma reação como endo- ou exotérmica depende da transferência líquida de calor. Em qualquer reação, o calor é absorvido e liberado. Por exemplo, a energia deve ser introduzida em uma reação de combustão para iniciá-la (acender um fogo com um fósforo), mas então mais calor é liberado do que o necessário.
Ficou alguma dúvida sobre os tipos de reações? Deixem nos comentários suas perguntas para que possamos ajudar!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também

O que são cloroplastos? Qual a função?

O que é o gás oxigênio? Como é produzido?

Corrosão, o que é? Exemplos e tipos!
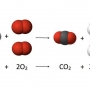
O que é equação química?