Funções Orgânicas Nitrogenadas e Haletos
Grupos funcionais na química referem-se a átomos específicos ligados em um determinado arranjo que conferem ao composto certas propriedades físicas e químicas. Dentro das funções químicas, temos as funções orgânicas nitrogenadas e os haletos, que merecem nossa atenção no artigo abaixo.
O papel dos grupos funcionais na química
Em química orgânica, um grupo funcional é um grupo específico de átomos ou ligações dentro de um composto que é responsável pelas reações químicas características desse composto. O mesmo grupo funcional se comportará de maneira semelhante, passando por reações semelhantes, independentemente do composto do qual faça parte. Grupos funcionais também desempenham um papel importante na nomenclatura de compostos orgânicos; combinar os nomes dos grupos funcionais com os nomes dos alcanos progenitores fornece uma maneira de distinguir os compostos.
Leia também
Os átomos de um grupo funcional estão ligados entre si e ao resto do composto por ligações covalentes. O primeiro átomo de carbono que se liga ao grupo funcional é chamado de carbono alfa; o segundo, o carbono beta; o terceiro, o carbono gama, etc. Similarmente, um grupo funcional pode ser referido como primário, secundário ou terciário, dependendo se está ligado a um, dois ou três átomos de carbono.
Grupos Funcionais e reatividade
Grupos funcionais desempenham um papel significativo no direcionamento e controle das reações orgânicas. As cadeias alquílicas são freqüentemente não-reativas, e a direção das reações específicas do local é difícil; cadeias alquílicas insaturadas com a presença de grupos funcionais permitem maior reatividade e especificidade. Freqüentemente, os compostos são funcionalizados com grupos específicos para uma reação química específica. Funcionalização refere-se à adição de grupos funcionais a um composto por síntese química. Através de métodos de síntese de rotina, qualquer tipo de composto orgânico pode ser anexado à superfície. Na ciência dos materiais, a funcionalização é empregada para alcançar as propriedades de superfície desejadas; grupos funcionais também podem ser usados para ligar covalentemente moléculas funcionais às superfícies de dispositivos químicos.
Em química orgânica, os grupos funcionais mais comuns são carbonilas (C = O), álcoois (-OH), ácidos carboxílicos (CO2H), ésteres (CO2R) e aminas (NH2). É importante ser capaz de reconhecer os grupos funcionais e as propriedades físicas e químicas que eles fornecem aos compostos.
Funções orgânicas nitrogenadas amina e amida e os haletos
Abaixo, destacamos as aminas e amidas, que são as Funções Orgânicas Nitrogenadas por possuírem o nitrogênio em suas composições e os Haletos, que são funções que possuem pelo menos um átomo halógeno.
Aminas como funções orgânicas nitrogenadas
Aminas são compostos caracterizados pela presença de um átomo de nitrogênio, um par isolado de elétrons e três substituintes.
O grupo funcional amina contém um átomo de nitrogênio básico com um par solitário de elétrons. Como tal, o grupo é derivado de amoníaco, no qual um ou mais átomos de hidrogênio foram substituídos por um substituinte contendo carbono. Compostos com o grupo nitrogênio ligado a um carbonila dentro da estrutura são chamados de amidas, e eles têm a estrutura R-CO-NR’R”. Grupos amina ligados a uma estrutura aromática (conjugada cíclica) são conhecidos como aminas aromáticas. A estrutura atomática diminui eficazmente a alcalinidade da amina, enquanto a presença do grupo amina diminui significativamente a reatividade do anel devido a um efeito dador de elétrons. O prefixo “amino-” ou o sufixo “-amina” é usado ao nomear um composto amina. Um composto orgânico com múltiplos grupos amino é chamado de diamina, triamina, tetramina, etc.
Estrutura da amina
As aminas são geralmente organizadas em categorias baseadas em seus ambientes de ligação. As aminas que tem um dos seus três átomos de hidrogênio substituídos por um substituinte alquilo ou aromático são referidas como aminas primárias. Aminas secundárias são aquelas que possuem dois substituintes e um hidrogênio ligado a um nitrogênio. Aminas terciárias são aminas cujos hidrogênios foram completamente substituídos por substituintes orgânicos. Finalmente, as aminas cíclicas são aquelas nas quais o nitrogênio foi incorporado a uma estrutura de anel, efetivamente tornando-a uma amina secundária ou terciária. A estrutura geral de uma amina contém um átomo de nitrogênio, um par isolado de elétrons e três substituintes. No entanto, é possível ter quatro substituintes orgânicos no nitrogênio, tornando-o um cátion de amônio com um centro de nitrogênio carregado.
Propriedades físicas das aminas
Aminas são capazes de ligação de hidrogênio. Como resultado, os pontos de ebulição destes compostos são mais altos do que os das fosfinas correspondentes, mas inferiores aos dos álcoois correspondentes, que ligam o hidrogênio em maior grau. As aminas também exibem alguma solubilidade na água. No entanto, a solubilidade diminui com um aumento nos átomos de carbono, devido à maior hidrofobicidade do composto à medida que o comprimento da cadeia aumenta. As aminas alifáticas, que são aminas ligadas a uma cadeia alquílica, exibem solubilidade em solventes polares orgânicos. Aminas aromáticas, que são aminas que participam de um anel conjugado, doam seu par solitário de elétrons para o anel de benzeno, e assim sua capacidade de se envolver em ligações de hidrogênio diminui. Isso resulta em uma diminuição na sua solubilidade em água e em pontos de alto ponto de ebulição.
Acidez e alcalinidade das aminas
Aminas do tipo NHRR ’e NR’R”R’ são moléculas quirais e podem sofrer inversão. Como a barreira para inversão é bastante baixa (aproximadamente 7 kcal / mol), esses compostos não podem ser resolvidos opticamente. Aminas são bases, e sua basicidade depende das propriedades eletrônicas dos substituintes (grupos alquila aumentam a basicidade; grupos arila diminuem), impedimento estérico, e o grau de solvatação da amina protonada. Em geral, o efeito dos grupos alquila aumenta a energia do par solitário de elétrons, elevando assim a basicidade. Assim, pode esperar-se que a basicidade de uma amina aumente com o número de grupos alquilo na amina. Além disso, o efeito do anel aromático desloca o par solitário de elétrons no nitrogênio para o anel, resultando em menor basicidade. A solvatação de aminas protonadas muda após sua conversão em compostos de amônio. Tipicamente, sais de compostos de amônio exibem a seguinte ordem de solubilidade em água: amônio primário (RNH3) > amônio secundário (R2NH2+) > amônio terciário (R3NH +). Sais de amônio quaternário geralmente exibem a menor solubilidade da série.
Preparação e reatividade da amina
Industrialmente, as aminas são preparadas a partir de amoníaco por alquilação com álcoois. Eles também podem ser preparados via redução de nitrilas a aminas usando hidrogênio na presença de um catalisador de níquel. As aminas são bastante reativas devido à sua basicidade e à sua nucleofilicidade. A maioria das aminas primárias são bons ligantes e reagem com íons metálicos para produzir complexos de coordenação. Uma das reações mais importantes para aminas é a formação de iminas, ou compostos orgânicos, onde o nitrogênio participa de uma ligação dupla, ao reagir com cetonas ou aldeídos.
Aplicações das aminas
As aminas são onipresentes na biologia. Muitas moléculas importantes são baseadas em amina, como neurotransmissores e aminoácidos. Suas aplicações no mundo incluem o início de material para tintas e modelos para design de medicamentos. Elas também são usados para tratamento de gás, como a remoção de CO2 dos gases de combustão.

As funções orgânicas nitrogenadas são aquelas que possuem nitrogênio em sua composição. (Foto: ThoughtCo)
Amida como função nitrogenada
Uma amida, também conhecida como amida ácida, são derivados de ácidos carboxílicos. Um ácido carboxílico contém o grupo funcional −COOH e, numa amida, a parte −OH desse grupo é substituído por um grupo −NH2. Então, as amidas contêm o grupo -CONH2. A ligação amida tem algumas propriedades interessantes que podem não ser óbvias em outras classes químicas. Amida também pode se referir à base conjugada de amônia (o ânion H2N−) ou de uma amina orgânica (um ânion R2N−).
Estrutura e colagem
As amidas mais simples são derivados de amoníaco em que um átomo de hidrogênio foi substituído por um grupo acilo. O conjunto é geralmente representado como RC (O) NH2 e é descrito como uma amida primária. Intimamente relacionadas e ainda mais numerosas são amidas secundárias que podem ser derivadas de aminas primárias (R′NH2) e tem a fórmula RC (O) NHR′. Amidas terciárias são comumente derivadas de aminas secundárias (R′R″NH) e possuem a estrutura geral RC (O) NR′R ″. Amidas são geralmente consideradas como derivados de ácidos carboxílicos nos quais o grupo hidroxila foi substituído por uma amina ou amônia.
O par solitário de elétrons no nitrogênio é deslocado para dentro do carbonila, formando assim uma dupla ligação parcial entre o N e o carbono do carbonilo. Consequentemente, o nitrogênio nas amidas não é piramidal. Uma última coisa a notar quando se olha para as ligações de uma amida é que há também uma ligação de hidrogênio presente entre os átomos de hidrogênio e nitrogênio dos grupos ativos.
Nomenclatura das amidas primárias
As amidas primárias são nomeadas mudando o nome do ácido soltando as terminações ácido -o ou ou ácido oico e adicionando -amida. O carbono carbonílico recebe o número de localização #1. Não é necessário incluir o número do local no nome porque é assumido que o grupo funcional estará no final da cadeia pai.
Nomenclatura das amidas secundárias
Amidas secundárias são nomeadas usando um N maiúsculo para designar que o grupo alquila está no átomo de nitrogênio. Os grupos alquilo ligados ao azoto são denominados substituintes. A letra N é usada para indicar que estão ligados ao nitrogênio.
Nomenclatura das Amidas Terciárias
As amidas terciárias são nomeadas da mesma maneira que as amidas secundárias, mas com dois N’s.
Basicidade das amidas
Em comparação com aminas, as amidas são bases muito fracas. Enquanto o ácido conjugado de uma amina tem um pKa de cerca de 9,5, o ácido conjugado de uma amida tem um pKa em torno de -0,5. Portanto, as amidas não possuem propriedades ácido-base claramente visíveis na água. Essa relativa falta de basicidade é explicada pela natureza de retirada de elétrons do grupo carbonila, onde o par isolado de elétrons no nitrogênio é deslocado pela ressonância. Por outro lado, as amidas são bases muito mais fortes que os ácidos carboxílicos, ésteres, aldeídos e cetonas.
Por causa da maior eletronegatividade do oxigênio, o carbonil (C = O) é um dipolo mais forte do que o dipolo N – C. A presença de um dipolo C = O e, em menor grau, um dipolo N-C, permite que as amidas atuem como aceitadores de ligação-H. Em amidas primárias e secundárias, a presença de dipolos N-H permite que as amidas também funcionem como doadores de ligação-H. Assim, as amidas podem participar na ligação de hidrogênio com água e outros solventes próticos; o átomo de oxigênio pode aceitar ligações de hidrogênio da água e os átomos de hidrogênio N-H podem doar ligações de hidrogênio. Como resultado de interações como estas, a solubilidade em água das amidas é maior que a dos hidrocarbonetos correspondentes. O próton de uma amida primária ou secundária não se dissocia prontamente sob condições normais; seu pKa é geralmente bem acima de 15. Inversamente, sob condições extremamente ácidas, o oxigênio carbonílico pode se tornar protonado com um pKa de aproximadamente -1.
Solubilidade das amidas
As solubilidades de amidas e esteres são aproximadamente comparáveis. Tipicamente, as amidas são menos solúveis do que as aminas comparáveis e os ácidos carboxílicos, uma vez que estes compostos podem doar e aceitar ligações de hidrogênio. Amidas terciárias, com a importante exceção de N, N-dimetilformamida, exibem baixa solubilidade em água.
Aplicações das amidas
As amidas são difundidas na natureza e na tecnologia como materiais estruturais. A ligação amida é facilmente formada, confere rigidez estrutural e resiste à hidrólise. Os nylons são poliamidas, assim como os materiais muito resilientes Aramida, Twaron e Kevlar. As ligações amidas constituem uma característica molecular definidora de proteínas, cuja estrutura secundária é devida em parte às habilidades de ligação de hidrogênio das amidas. As ligações amida em um contexto bioquímico são chamadas de ligações peptídicas quando ocorrem na cadeia principal de uma proteína e ligações isopeptídicas quando ocorrem em uma cadeia lateral da proteína. Proteínas podem ter papéis estruturais, como no cabelo ou seda de aranha, mas também quase todas as enzimas são proteínas. Amidas de baixo peso molecular, tais como dimetilformamida (HC(O)N(CH3)2), são solventes comuns. Muitas drogas são amidas, incluindo paracetamol, penicilina e LSD. Além disso, as N-alquilamidas vegetais possuem uma ampla gama de funcionalidades biológicas.
Funções químicas haletos
Um halogeneto é uma fase binária, da qual uma parte é um átomo de halogênio e a outra parte é um elemento ou radical que é menos eletronegativo (ou mais eletropositivo) que o halogênio, para produzir um fluoreto, cloreto, brometo, iodeto, astatida, ou teoricamente composto de tenessina. Os metais alcalinos combinam-se diretamente com halogêneos sob condições apropriadas, formando halogenetos de fórmula geral, MX(X = F, Cl, Br ou I). Muitos sais são haletos. Todos os metais do Grupo 1 formam halogenetos que são sólidos brancos à temperatura ambiente. Um ón halogenado é um átomo de halogêneo com carga negativa. Os ânions halogenados são o fluoreto (F−), cloreto (Cl−), brometo (Br-), iodeto (I−) e astatida (At−). Tais íons estão presentes em todos os sais halogenados iônicos. Os halogenetos contêm halogenetos. Todos estes halogenetos são sólidos cristalinos, incolores e de elevado ponto de fusão, com entalpias de formação altamente negativas.
Compostos halogenados como KCl, KBr e KI podem ser testados com solução de nitrato de prata, AgNO3. O halogênio reagirá com Ag + e formará um precipitado, com cores variadas dependendo do halogênio:
AgF: sem precipitaç~]ao
AgCl: branco
AgBr: cremoso (amarelo pálido)
AgI: verde (amarelo)
Para compostos orgânicos contendo haletos, o teste de Beilstein é usado.
Usos dos haletos
Os haletos de metal são usados em lâmpadas de descarga de alta intensidade chamadas de lâmpadas de iodetos metálicos, como as usadas nas modernas luzes das ruas. Estes são mais eficientes energeticamente do que as lâmpadas de vapor de mercúrio, e tem melhor reprodução de cores do que as lâmpadas de sódio de alta pressão laranja. As lâmpadas de iodetos metálicos também são comumente usadas em estufas ou em climas chuvosos para suplementar a luz solar natural. Os haletos de prata são usados em filmes e papéis fotográficos. Quando o filme é desenvolvido, os haletos de prata que foram expostos à luz são reduzidos a prata metálica, formando uma imagem. Haletos também são usados em pasta de solda, geralmente como um equivalente Cl ou Br.
Haletos na química orgânica
A química orgânica sintética geralmente incorpora halogênios em compostos organohalídicos.
Compostos
Exemplos de compostos halogenados são:
Cloreto de sódio (NaCl)
Cloreto de potássio (KCl)
Iodeto de potássio (KI)
Cloreto de lítio (LiCl)
Cloreto de cobre (II) (CuCl2)
Cloreto de prata (AgCl)
Cloreto de cálcio (CaCl2)
Fluoreto de Cloro (ClF)
Organohaletos
Bromometano (CH3Br)
Iodofórmio (CHI3)
Cloreto de hidrogênio (HCl)
Ficou alguma dúvida? Deixem nos comentários suas perguntas!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também
Reações endotérmicas e exotérmicas

O que são óxidos ácidos?
O que é o Sistema Excretor? Quais suas funções?
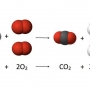
O que é equação química?