Lei de Hess
A lei de Hess afirma que a mudança de energia em uma reação química geral é igual à soma das mudanças de energia nas reações individuais que a compõem. Em outras palavras, a mudança de entalpia de uma reação química (o calor da reação a pressão constante) não depende do caminho entre os estados inicial e final. A lei é uma variação da primeira lei da termodinâmica e conservação de energia.
Importância da lei de Hess
Como a lei de Hess é verdadeira, é possível dividir uma reação química em várias etapas e usar as entalpias padrão da formação para encontrar a energia geral de uma reação química. As tabelas de entalpia padrão são compiladas a partir de dados empíricos, geralmente adquiridos por calorimetria. Usando essas tabelas, é possível calcular se uma reação mais complexa é ou não termodinamicamente favorável.
Leia também
Aplicações da Lei de Hess
Além de calcular a entalpia de uma reação, em vez de medi-la diretamente, a lei de Hess é usada para:
Encontre afinidades eletrônicas com base na energia teórica da rede.
Calcular a mudança de calor das transições de fase.
Calcular a mudança de calor quando uma substância altera os alótropos.
Encontrar o calor de formação de um intermediário instável em uma reação.
Encontrar a energia da rede dos compostos iônicos.
Lei de Hess: como fazer?
O calor de qualquer reação ΔHf para uma reação específica é igual à soma dos aquecimentos da reação para qualquer conjunto de reações que, em resumo, sejam equivalentes à reação geral.
Um exemplo de aplicação está no gás hidrogênio, que é de potencial interesse nacional como combustível limpo, pode ser gerado pela reação do carbono (carvão) e da água:
C (s) + 2H2O (g) → CO2 (g) + 2H2 (g)
A calorimetria revela que essa reação requer a entrada de 90,1 kJ de calor para cada mole de C (s) consumido. Por convenção, quando o calor é absorvido durante uma reação, consideramos a quantidade de calor um número positivo: em termos químicos, q > 0 para uma reação endotérmica. Quando o calor é desenvolvido, a reação é exotérmica e q < 0 por convenção.
É interessante perguntar para onde vai essa energia de entrada quando a reação ocorre. Uma maneira de responder a essa pergunta é considerar o fato de que a reação converte um combustível, C (s), em outro, H2 (g). Para comparar a energia disponível em cada combustível, podemos medir o calor evoluído na combustão de cada combustível com uma mole de oxigênio. Observamos que
C (s) + O2 (g) → CO2 (g)
Produz 393,5kJ para uma mole de carbono queimado; portanto, q = -393,5kJ. A reação
2H2 (g) + O2 (g) → 2H2O (g)
Produz 483,6 kJ para duas moles de gás hidrogênio queimado, então q = -483,6 kJ. É evidente que mais energia está disponível na combustão do combustível de hidrogênio do que na combustão do combustível de carbono, portanto, não é surpreendente que a conversão do combustível de carbono em combustível de hidrogênio exija a entrada de energia.
De considerável importância é a observação de que a entrada de calor na equação [2], 90,1 kJ, é exatamente igual à diferença entre o calor evoluído, -393,5 kJ, na combustão de carbono e o calor evoluído, -483,6 kJ, na combustão de hidrogênio. Isso não é coincidência: se pegarmos a combustão de carbono e adicionarmos o inverso da combustão de hidrogênio, obteremos
C (s) + O2 (g) → CO2 (g) Equação 1
2H2O (g) → 2H2 (g) + O2 (g) Equação 2
C (s) + O2 (g) + 2H2O (g) → CO2 (g) + 2H2 (g) + O2 (g) Equação 3
Cancelando o O2 (g) de ambos os lados, uma vez que não é líquido nem reagente nem produto, a equação 3 é equivalente à equação 2. Assim, pegar a combustão de carbono e “subtrair” a combustão de hidrogênio (ou mais precisamente, adicionar o inverso da combustão de hidrogênio) produz a equação 2. E, o calor da combustão de carbono menos o calor da combustão de hidrogênio é igual ao calor da equação 2. Ao estudar muitas reações químicas dessa maneira, descobrimos que esse resultado, conhecido como Lei de Hess, é geral.
A lei de Hess estabelece as relações em uma fórmula para que ela seja corretamente equilibrada e se mantenha constante. (Foto: Coursera)
Passo a passo para entalpia de combustão
Equilibre as equações individuais
Se necessário, procure entalpias padrão
Virar as equações, se necessário, para cancelar termos em lados opostos
Alterar a equação requer uma mudança de sinal do H daquele passo individual
Resuma as etapas individuais
Entalpia padrão de formação
A seguinte equação é usada para calcular a entalpia padrão de formação:
ΔrH⊖ = ∑υH⊖ (produtos) ∑∑HH (reagentes)
Se ΔHo é positivo, a reação é endotérmica
Se ΔHo é negativo, a reação é exotérmica
Energia de formação padrão de Gibb
A Energia Livre de Formação da Gibb Padrão é calculada usando os princípios da lei de Hess. A seguinte equação é usada para esses cálculos:
ΔfG⊖ = ∑vΔfG⊖ (produtos) −∑vΔfG⊖ (reagentes) (6)
Entropia padrão
A Entropia Padrão de uma reação é calculada usando a seguinte equação:
ΔrS⊖ = ∑υS⊖ (produtos) ∑∑S⊖ (reagentes) (7)
Observe que, ao contrário da Gibbs, a terceira lei da termodinâmica nos permite trabalhar em absoluto (S) em vez de diferenças em relação a um estado de referência (padrão).
Ficou alguma dúvida? Deixem nos comentários suas perguntas e iremos responder!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também

O que é metano? Como se forma?

O que é o gás oxigênio? Como é produzido?

O que é e para que serve a energia cinética?
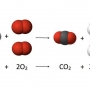
O que é equação química?