Funções Orgânicas Oxigenadas
Funções orgânicas são aquelas que contém Carbono em suas composições. A química tem uma área toda de estudos dedicada a essas funções. Diferenciar os tipos de funções e a composição delas é essencial para o estudo correto e completo da química.
O que são funções orgânicas oxigenadas?
Funções orgânicas oxigenadas são aquelas que tem oxigênio em sua composição. São funções orgânicas oxigenadas:
Os Álcoois
Os Éteres
Os Aldeídos
As Cetonas
Os Ácidos Carboxílicos
Os Ésteres
Leia também
Os Fenóis
Descreveremos cada uma dessas funções abaixo em mais detalhes.
Função oxigenada álcool
Álcoois são grupos funcionais caracterizados pela presença de um grupo -OH. Álcoois são compostos orgânicos nos quais o grupo funcional hidroxila (-OH) está ligado a um átomo de carbono. Os álcoois são uma classe importante de moléculas com muitos usos científicos, médicos e industriais.
Nomenclatura de Álcoois
De acordo com o sistema de nomenclatura IUPAC, um álcool é denominado pela queda do terminal “-o” da cadeia de carbono original (alcano, alceno ou alcino na maioria dos casos) e a adição de “-ol” como final. Se a localização do grupo hidroxila tiver que ser especificada, um número é inserido entre o nome do alcano pai e o “-ol” (propan-1-ol) ou antes do nome IUPAC (1-propanol). Se um grupo de maior prioridade estiver presente, como um aldeído, cetona ou ácido carboxílico, então é necessário usar o prefixo “hidroxi” em vez do final “-ol”. Os álcoois são classificados como primários, secundários ou terciários, com base no número de átomos de carbono ligados ao átomo de carbono que contém o grupo hidroxila.
Estrutura e propriedades físicas dos álcoois
A estrutura de um álcool é semelhante à da água, pois tem uma forma curva. Este arranjo geométrico reflete o efeito da repulsão de elétrons e o aumento do volume estérico dos substituintes no átomo central de oxigênio. Como a água, os álcoois são polares, contendo uma distribuição assimétrica de carga entre os átomos de oxigênio e hidrogênio. A alta eletronegatividade do oxigênio comparado ao carbono leva ao encurtamento e fortalecimento da ligação -OH. A presença dos grupos -OH permite a ligação de hidrogênio com outros grupos -OH, átomos de hidrogênio e outras moléculas. Como os álcoois são capazes de formar pontes de hidrogênio, seus pontos de ebulição são mais altos do que aqueles de suas moléculas originais.
Os álcoois são capazes de participar de muitas reações químicas. Eles freqüentemente sofrem desprotonação na presença de uma base forte. Este fraco comportamento ácido resulta na formação de um sal alcóxido e de uma molécula de água. Grupos hidroxila sozinhos não são considerados bons grupos de saída. Muitas vezes, sua participação em reações de substituição nucleofílica é instigada pela protonação do átomo de oxigênio, levando à formação de uma porção de água, um melhor grupo de saída. Os álcoois podem reagir com ácidos carboxílicos para formar um éster e podem ser oxidados em aldeídos ou ácidos carboxílicos.
Álcoois tem muitos usos em nosso mundo cotidiano. Eles são encontrados em bebidas, anticongelantes, anti-sépticos e combustíveis. Eles podem ser usados como conservantes para espécimes em ciência, e podem ser usados na indústria como reagentes e solventes porque eles exibem uma capacidade de dissolver substâncias polares e não polares.
Função orgânica dos Éteres
Os éteres são uma classe de compostos orgânicos caracterizados por um átomo de oxigênio ligado a dois grupos alquila ou arila.
Estrutura dos éteres
Os éteres são uma classe de compostos orgânicos que contêm um grupo éter. Um grupo éter é um átomo de oxigênio ligado a dois grupos alquilo ou arilo. Eles seguem a fórmula geral R-O-R’. A ligação C-O-C é caracterizada por ângulos de ligação de 104,5 graus, sendo as distâncias de C-O cerca de 140 picômetros. O oxigênio do éter é mais eletronegativo que os carbonos. Assim, os hidrogênios alfa são mais ácidos do que nas cadeias regulares de hidrocarbonetos.
Nomenclatura de Éteres
Existem duas maneiras de nomear éteres. A maneira mais comum é identificar os grupos alquílicos em cada lado do átomo de oxigênio em ordem alfabética, e depois escrever “éter”. Por exemplo, éter etílico de metila é o éter que tem um grupo etila e um grupo metila em ambos os lados do átomo de oxigênio. Se os dois grupos alquilo são idênticos, o éter é chamado di [alquil] éter. Por exemplo, o éter dietílico é o éter com um grupo etilo em cada lado do átomo de oxigênio.
A outra maneira de nomear éteres é o método formal IUPAC. Desta forma, a forma é: [cadeia alquílica curta] [oxi] [cadeia alquílica longa]. Por exemplo, o nome IUPAC para etil metil éter seria metoxietano.
Em éteres cíclicos, o caule do composto é conhecido como oxacicloalcano. O oxa é um indicador da substituição do carbono por um oxigênio no anel. Um exemplo é o oxaciclopentano, um anel de cinco membros no qual existem quatro átomos de carbono e um átomo de oxigênio.
Propriedades dos éteres
Os éteres são bastante não polares devido à presença de um grupo alquil em cada lado do oxigênio central. A presença dos volumosos grupos alquílicos adjacentes significa que o átomo de oxigênio é incapaz de participar da ligação de hidrogênio. Os éteres, portanto, tem pontos de ebulição mais baixos em comparação com álcoois de peso molecular similar. No entanto, à medida que a cadeia alquílica dos éteres se torna mais longa, a diferença nos pontos de ebulição torna-se menor. Isso se deve ao efeito do aumento das interações de Van der Waals à medida que o número de carbonos aumenta e, portanto, o número de elétrons aumenta também. Os dois pares solitários de elétrons presentes nos átomos de oxigênio possibilitam que os éteres formem ligações de hidrogênio com a água. Os éteres são mais polares do que os alcenos, mas não tão polares quanto os ésteres, álcoois ou amidas de estruturas comparáveis.
Reações dos éteres
Os éteres tem reatividade química relativamente baixa, mas ainda são mais reativos que os alcanos. Apesar de resistirem à hidrólise, são frequentemente clivados por ácidos, o que resulta na formação de um halogeneto de alquilo e um álcool. Os éteres tendem a formar peróxidos na presença de oxigênio ou ar. A fórmula geral é R-O-O-R’. Os éteres podem servir como bases de Lewis e Bronsted, servindo para doar elétrons em reações ou aceitar prótons. Os éteres podem ser formados em laboratório através da desidratação de álcoois (2R-OH → ROR + H2O em alta temperatura), deslocamento nucleofílico de halogenetos de alquila por alcóxidos (R-ONa + R’-X → RO-R’+ NaX), ou adição eletrofílica de álcoois a alcenos (R2C = CR2 + R-OH → R2CH-C (-OR) -R2).
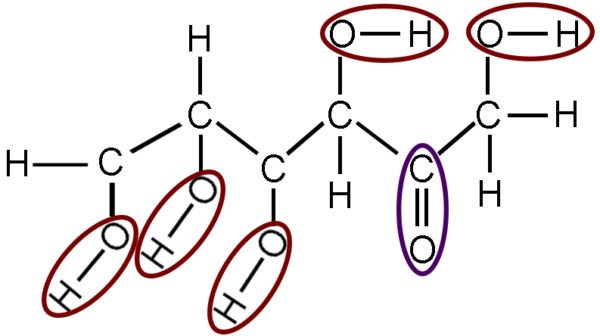
Funções orgânicas oxigenadas são aquelas que contém oxigênio em sua composição. (Foto: Lumen Learning)
Funções orgânicas de Aldeídos e Cetonas
Aldeídos e cetonas são classes de compostos orgânicos que contêm um grupo carbonila (C = O). Em química orgânica, um grupo carbonila é um grupo funcional que tem um carbono duplo ligado a um átomo de oxigênio: C = O.
Cetonas
Quando um grupo funcional carbonilo é colocado dentro de uma molécula, é conhecido como uma cetona. As cetonas são compostos orgânicos com a estrutura RC (= O) R ’, onde R e R’ podem ser uma variedade de substituintes contendo carbono. As regras de nomenclatura IUPAC ditam que as moléculas cetonas são nomeadas alterando o sufixo da molécula de carbono original para “ona”. Se a posição da cetona tiver que ser especificada, um número é colocado entre o nome da cadeia pai e o “-ona” prefixo (por exemplo, propan-2-ona), ou no início do nome IUPAC. Os prefixos “oxo-” e “ceto-” são usados para descrever o grupo funcional cetona.
O carbono cetônico é sp2 hibridizado, e adota uma geometria planar trigonal ao redor do carbono cetônico. Como tal, os ângulos de ligação C – C – O e C – C – C são de aproximadamente 120 graus. Devido ao grupo carbonilo, as cetonas são polares e são capazes de interagir com outros compostos através da ligação de hidrogênio; essa capacidade de ligação de hidrogênio torna as cetonas mais solúveis em água do que os compostos de metileno relacionados. As cetonas geralmente não são doadoras de ligações de hidrogênio e tendem a não exibir atrativos intermoleculares com outras cetonas. Como resultado, as cetonas são frequentemente mais voláteis do que álcoois e ácidos carboxílicos de pesos moleculares comparáveis. As cetonas possuem alfa-hidrogênios que participam do tautomerismo ceto-enólico. Na presença de uma base forte, ocorrerá a formação de enolatos e a subseqüente desprotonação do enolato.
Aldeídos
Um aldeído é um composto orgânico que contém um grupo carbonila com o carbono central ligado a um hidrogênio e um grupo R (R-CHO). Aldeídos diferem de cetonas em que o carbonilo é colocado no final do esqueleto de carbono, em vez de entre dois átomos de carbono do backbone. Como as cetonas, os aldeídos são sp2 hibridados e podem existir no tautômero ceto ou enol. Os aldeídos são nomeados descartando o sufixo da molécula mãe e adicionando o sufixo “-al”. Por exemplo, uma cadeia de três carbonos com um grupo aldeído em um carbono terminal seria propanal. Se houver grupos funcionais de ordem superior no composto, o prefixo “oxo-” pode ser usado para indicar qual átomo de carbono faz parte do grupo aldeído. Se o local do aldeído tiver que ser especificado, um número poderá ser usado entre a cadeia pai e o sufixo, ou no início do nome composto.
Semelhanças de Aldeídos e Cetonas
Tanto os aldeídos como as cetonas existem em equilíbrio com suas formas enol; a forma enol é definida como um alceno com um grupo hidroxilo afixado a um dos átomos de carbono que compõe a ligação dupla. A forma ceto predomina no equilíbrio para a maioria das cetonas. No entanto, a forma enol é importante para algumas reações, porque a forma enolada desprotonada é um nucleófilo forte. O equilíbrio é fortemente conduzido termodinamicamente, e à temperatura ambiente a forma ceto é favorecida. A interconversão pode ser catalisada pela presença de um ácido ou de uma base.
Cetonas e aldeídos podem ambos ser facilmente reduzidos a álcoois, usualmente na presença de um forte agente redutor tal como boro-hidreto de sódio. Na presença de agentes oxidantes fortes, eles podem ser oxidados em ácidos carboxílicos. Como eletrófilos, estão sujeitos ao ataque de nucleófilos, o que significa que participam de muitas reações de adição nucleofílica.
Função orgânica dos Ácidos Carboxílicos
Ácidos carboxílicos são ácidos orgânicos que contêm um átomo de carbono que participa de um grupo funcional hidroxila e carbonila. Um grupo carboxilo (COOH) é um grupo funcional que consiste num grupo carbonilo (C = O) com um grupo hidroxilo (O-H) ligado ao mesmo átomo de carbono. Os grupos carboxilo têm a fórmula -C (= O) OH, normalmente escrita como -COOH ou CO2H. Os ácidos carboxílicos são uma classe de moléculas que se caracterizam pela presença de um grupo carboxílico. Como doadores de prótons, os ácidos carboxílicos são caracterizados como ácidos de Brønsted-Lowry. Ácidos com dois ou mais grupos carboxílicos são chamados dicarboxílicos, tricarboxílicos, etc. Sais e ésteres de ácidos carboxílicos são chamados carboxilatos. Os iões carboxilatos são estabilizados por ressonância. Esta estabilidade aumentada leva ao aumento da acidez em comparação com o dos álcoois. Geralmente, na nomenclatura IUPAC, os ácidos carboxílicos têm um sufixo “-oicoácido”, embora “ácido ico” seja o sufixo mais comumente usado.
Propriedades Físicas dos Ácidos Carboxílicos
Ácidos carboxílicos atuam como aceitadores de ligação de hidrogênio, devido ao grupo carbonila, e doadores de ligação de hidrogênio, devido ao grupo hidroxila. Como resultado, eles freqüentemente participam de pontes de hidrogênio. Ácidos carboxílicos geralmente existem como pares diméricos em meios não polares devido à sua tendência a “auto-associação”. Esta tendência à ligação de hidrogênio lhes confere maior estabilidade, bem como pontos de ebulição mais altos em relação ao ácido em solução aquosa. Ácidos carboxílicos são moléculas polares; elas tendem a ser solúveis em água, mas à medida que a cadeia alquílica fica mais longa, sua solubilidade diminui devido à natureza hidrofóbica crescente da cadeia de carbono. Os ácidos carboxílicos são caracterizados como ácidos fracos, o que significa que eles não se dissociam completamente para produzir cátions de H+ em uma solução aquosa neutra.
Aplicações e reatividade de ácidos carboxílicos
Ácidos carboxílicos são usados na produção de polímeros, produtos farmacêuticos, solventes e aditivos alimentares. Como tal, são frequentemente produzidos industrialmente em grande escala. Ácidos carboxílicos são geralmente produzidos a partir da oxidação de aldeídos e hidrocarbonetos e desidrogenação catalisada por base de álcoois. Eles podem ser produzidos em laboratório para reações em pequena escala via oxidação de álcoois primários ou aldeídos, clivagem oxidativa de olefinas e através da hidrólise de nitrilos, ésteres ou amidas.
Ácidos carboxílicos são amplamente utilizados como precursores para a produção de outros compostos. Por exposição a uma base, o ácido carboxílico é desprotonado e forma um sal carboxilato. Eles também reagem com álcoois para produzir ésteres e podem sofrer reações de redução por hidrogenação ou pelo uso de agentes redutores. Existem também várias reações especializadas que participam os ácidos carboxílicos que levam à formação de aminas, aldeídos e cetonas.
Função química dos Ésteres
Ésteres são grupos funcionais produzidos a partir da condensação de um álcool com um ácido carboxílico, e são nomeados com base nesses componentes. Os ésteres são um grupo funcional importante na química orgânica, e geralmente são escritos RCOOR’ ou RCO2R’.
Como de costume, R e R’ são ambos grupos alquila ou grupos iniciando com carbono. Os ésteres são derivados de ácidos carboxílicos onde o grupo hidroxilo (OH) foi substituído por um grupo alcoxi (O-R). Eles são comumente sintetizados a partir da condensação de um ácido carboxílico com um álcool:
RCO2H + R′OH → RCO2R′ + H2O
Os ésteres são onipresentes. A maioria das gorduras e óleos que ocorrem naturalmente são os ésteres de ácidos graxos do glicerol. Os ésteres são tipicamente perfumados, e aqueles com pesos moleculares baixos o suficiente para serem voláteis são comumente usados como perfumes e são encontrados em óleos essenciais e feromônios. Ésteres polimerizados, ou poliésteres, são plásticos importantes, com monômeros ligados por unidades estéricas como esta:
CO2RCO2RCO2R… etc.
Nomenclatura dos ésteres
Os nomes de ésteres são derivados do álcool e do ácido pai. Por exemplo, o éster formado por etanol e ácido etanoico é conhecido como etanoato de etilo; “Etanol” é reduzido a “etila”, enquanto “etanoico” é reduzido a “etanoato”. Outros exemplos de nomes de éster incluem propanoato de metila, de metanol e ácido propanoico e octanoato de butila, de butano e ácido octanoico.
No caso de ésteres formados a partir de ácidos carboxílicos comuns, são utilizados, por vezes, termos mais coloquiais. Por exemplo, o ácido etanoico é mais comumente conhecido como ácido acético e, portanto, seus ésteres contêm “acetato” em vez de “etanoato” em seus nomes. Outras substituições desse tipo incluem “formato” em vez de “metanoato”, “propionato” em vez de “propanoato” e “butirato” em vez de “butanoato”.
As fórmulas químicas de ésteres orgânicos são tipicamente escritas no formato de RCO2R’, onde R e R’ são as partes de hidrocarboneto do ácido carboxílico e álcool, respectivamente. Por exemplo, acetato de butila, sistematicamente conhecido como ácido etanoico, é derivado de butanol e ácido acético e seria escrito CH3CO2C4H9. Apresentações alternativas são comuns, incluindo BuOAc e CH3COOC4H9. Ésteres cíclicos são conhecidos como lactonas.
Estrutura e ligação ésteres
Os ésteres contêm um centro de carbonila, que dá origem a ângulos de ligação de 120 graus C-C-O e O-C-O devido à hibridação sp2. Ao contrário das amidas, os ésteres são grupos funcionais estruturalmente flexíveis porque a rotação em torno das ligações C-O-C tem uma menor barreira energética. Sua flexibilidade e baixa polaridade afetam suas propriedades físicas em escala macroscópica; elas tendem a ser menos rígidas, levando a um ponto de fusão mais baixo e mais voláteis, levando a um ponto de ebulição mais baixo do que as amidas correspondentes. O pKa dos alfa-hidrogênios, ou os hidrogênios ligados ao carbono adjacente ao carbonila, em ésteres, é em torno de 25, tornando-os essencialmente não-ácidos, exceto na presença de bases muito fortes.
Propriedades físicas e caracterização dos ésteres
Os ésteres são mais polares que os éteres, mas menos que os álcoois. Eles participam de ligações de hidrogênio como receptores de ligação de hidrogênio, mas não podem atuar como doadores de ligação de hidrogênio, diferentemente de seus álcoois de origem e ácidos carboxílicos. Esta capacidade de participar na ligação de hidrogénio confere alguma solubilidade em água, dependendo do comprimento das cadeias alquilo ligadas. Como não possuem hidrogênio ligado a oxigênio, como álcoois e ácidos carboxílicos, os ésteres não se auto-associam. Consequentemente, os ésteres são mais voláteis do que os ácidos carboxílicos de peso molecular semelhante.
Reatividade dos ésteres
Os ésteres reagem com nucleófilos no carbono carbonílico. O carbonil é fracamente eletrofílico, mas é atacado por nucleófilos fortes, como aminas, alcóxidos, fontes de hidreto e compostos de organolítio. A eletrofilicidade do carbonilo pode aumentar se for protonado; em meio ácido, um éster pode ser hidrolisado por água para formar um ácido carboxílico e um álcool. As ligações C-H adjacentes ao carbonilo são fracamente ácidas, mas sofrem desprotonação com bases fortes. Este processo é o que geralmente inicia reações de condensação. O oxigênio de carbonila é fracamente básico (menos do que em amidas), mas pode formar adutos com ácidos de Lewis.
Os fenóis nas funções orgânicas
Em química orgânica, o grupo fenilo ou anel fenilo é um grupo cíclico de átomos com a fórmula C6H5. Os grupos fenilo estão intimamente relacionados com o benzeno e podem ser vistos como um anel de benzeno, menos um hidrogênio, que pode ser substituído por algum outro elemento ou composto para servir como um grupo funcional. Os grupos fenilo têm seis átomos de carbono ligados entre si num anel planar hexagonal, cinco dos quais estão ligados a átomos individuais de hidrogênio, com o carbono remanescente ligado a um substituinte. Grupos fenil são comuns na química orgânica. Embora frequentemente representados com ligações duplas e simples alternadas, os grupos fenilo são quimicamente aromáticos e exibem comprimentos de ligação quase iguais entre os átomos de carbono no anel.
Nomenclatura dos fenóis
Geralmente, um “grupo fenilo” é sinônimo de C6H5 – e é representado pelo símbolo Ph ou, arcaicamente, Φ. O benzeno é algumas vezes denotado como PhH. Grupos fenilo são geralmente ligados a outros átomos ou grupos. Por exemplo, o trifenilmetano (Ph3CH) tem três grupos fenilo ligados ao mesmo centro de carbono. Muitos ou mesmo a maioria dos compostos fenílicos não são descritos com o termo “fenilo”. Por exemplo, o derivado cloro C6H5Cl é normalmente chamado de clorobenzeno, embora possa ser chamado cloreto de fenila. Em casos especiais (e raros), grupos fenilo isolados são detectados: o anião fenilo (C6H5-), o catião fenilo (C6H5 +) e o radical fenilo (C6H5).
Embora Ph e fenilo denotem exclusivamente C6H5, os derivados substituídos também são descritos utilizando a terminologia de fenilo. Por exemplo, O2NC6H4 é nitrofenilo e F5C6 é pentafluorofenilo. Grupos fenilo monossubstituídos (isto é, benzenos dissubstituídos) estão associados a reacções de substituição aromáticas electrofílicas e os produtos seguem o padrão de substituição do areno. Assim, um determinado composto fenil substituído tem três isômeros, orto (1,2-dissubstituição), meta (1,3-dissubstituição) e para (1,4-dissubstituição). Um composto fenílico dissubstituído (benzeno tri-substituído) pode ser, por exemplo, 1,3,5-trissubstituído ou 1,2,3-tri-substituído. Graus mais altos de substituição, dos quais o grupo pentafluorofenil é um exemplo, existem e são nomeados de acordo com a nomenclatura IUPAC.
Estrutura e caracterização dos fenóis
Compostos de fenila são derivados do benzeno (C6H6), pelo menos conceitualmente e muitas vezes em termos de sua produção. Em termos de suas propriedades eletrônicas, o grupo fenil está relacionado a um grupo vinil. É geralmente considerado um grupo indutor de retirada (-I), devido à maior eletronegatividade dos átomos de carbono sp2, e um grupo doador de ressonância (+M), devido à capacidade de seu sistema π de doar densidade eletrônica quando a conjugação é possível. [4] O grupo fenilo é hidrofóbico. Grupos fenil tendem a resistir à oxidação e redução. Os grupos fenilo (como todos os compostos aromáticos) têm maior estabilidade em comparação com a ligação equivalente em grupos alifáticos (não aromáticos). Esta estabilidade aumentada é devida às propriedades únicas dos orbitais moleculares aromáticos.
Preparação, ocorrência e aplicações dos fenóis
Os grupos fenilo são normalmente introduzidos utilizando reagentes que se comportam como fontes do ânion fenilo ou do cátion fenilo. Reagentes representativos incluem fenil-lítio (C6H5Li) e brometo de fenilmagnésio (C6H5MgBr). Os eletrófilos atacam o benzeno para dar derivados de fenil:
C6H6 + E + → C6H5E + H +
Onde:
E + (o “eletrófilo”) = Cl +, NO2 +, SO3
Essas reações são chamadas de substituições aromáticas eletrofílicas. Grupos fenil são encontrados em muitos compostos orgânicos, tanto naturais como sintéticos (ver figura). O mais comum entre os produtos naturais é o aminoácido fenilalanina, que contém um grupo fenila. Um dos principais produtos da indústria petroquímica é o “BTX”, que consiste em benzeno, tolueno e xileno – todos os quais são blocos de construção para compostos fenílicos. O poliestireno polimérico é derivado de um monômero contendo fenila e deve suas propriedades à rigidez e hidrofobicidade dos grupos fenila. Muitas drogas, assim como muitos poluentes, contêm anéis fenílicos. Um dos compostos contendo fenilo mais simples é o fenol, C6H5OH. Costuma-se dizer que a estabilidade de ressonância do fenol o torna um ácido mais forte do que o dos álcoois alifáticos, como o etanol (pKa = 10 contra 16-18). No entanto, uma contribuição significativa é a maior eletronegatividade do carbono sp2 alfa em fenol comparado ao carbono sp3 alfa em álcoois alifáticos.
Ficou alguma dúvida sobre o estudo das funções químicas? Deixem nos comentários suas perguntas e iremos responder!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também

O que é chuva ácida?
O que é equação química?

O que são funções inorgânicas?

Qual a classificação das proteínas?